Spectre de Raies et Stabilité de l'Atome
En étudiant le spectre de raies de l'atome d'hydrogène, Balmer (1885) remarqua que les longueurs d'onde des raies observées satisfont à la relation :
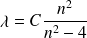 avec
avec
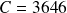 Å.
Å.
Rydberg (en 1889) transforma cette relation sous la forme :
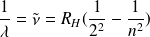
où
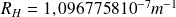 , désigne la constante de Rydberg. Cette relation a pu être généralisée et appliquée aux autres séries du spectre de l'hydrogène :
, désigne la constante de Rydberg. Cette relation a pu être généralisée et appliquée aux autres séries du spectre de l'hydrogène :
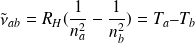
avec
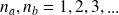 ,
,
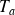 et
et
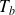 sont appelés termes spectraux.
sont appelés termes spectraux.
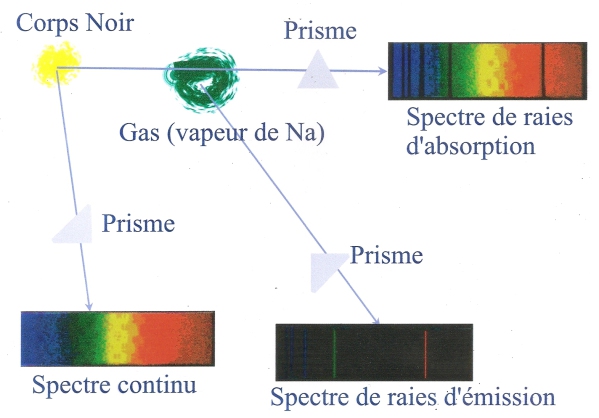
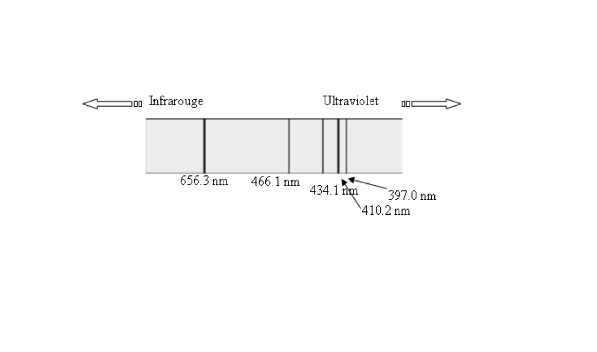
Pour expliquer cette régularité des raies spectrales et la présence de nombres entiers, il fallait connaître la structure de l'atome.
Les premiers modèles de l'atome ne sont apparus qu'au début du siècle dernier (J.J. Thomson (1904) et Rutherford (1911)). Il est important de rappeler qu'à ces dates on venait à peine de découvrir la charge électronique (Thomson 1897) ce qui ouvrait la voie à d'autres découvertes et expériences sur les objets microscopiques.
On rappelle brièvement que le modèle de Thomson suppose que l'atome est une boule homogène d'électricité à l'intérieur de laquelle les électrons négatifs peuvent se déplacer. Ce modèle allait être abandonné après les expériences de diffusion réalisées par Rutherford (1911). Le modèle proposé à partir de ces expériences décrit l'atome comme une charge ponctuelle positive concentrée dans une zone très petite de l'espace autour de laquelle gravitent les électrons selon un schéma planétaire. Mais, si le premier modèle ne permet pas d'associer les raies spectrales aux fréquences propres du modèle, le second se heurte au problème de la stabilité de l'atome et montre encore une fois les limites de la physique classique (en effet, d'après les lois de l'électrodynamique l'électron en mouvement sur son orbite devrait rayonner et perdre de son énergie et donc devrait retomber sur le noyau).
Il a fallu attendre les travaux de Bohr en 1913 pour voir apparaître un modèle cohérent (pour l'époque). En effet, reprenant les résultats de Rutherford, Bohr envisage un modèle planétaire et postule que :
Seuls certains niveaux d'énergie peuvent être occupés par les électrons qui décrivent des orbites circulaires telles que :
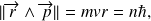 où
où
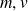 et
et
 désignent respectivement la masse de l'électron, sa vitesse sur son orbite et sa distance au noyau.
désignent respectivement la masse de l'électron, sa vitesse sur son orbite et sa distance au noyau.
 est un entier et
est un entier et
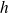 la constante de Planck.
la constante de Planck.L'électron est sur une orbite stationnaire. Il n'y a absorption ou émission que lorsque l'électron change d'orbite (ou de niveau d'énergie)
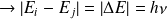 , où
, où
 est la fréquence du rayonnement absorbé ou émis et
est la fréquence du rayonnement absorbé ou émis et
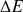 l'écart entre les deux niveaux concernés.
l'écart entre les deux niveaux concernés.
Rappels : (voir cours d'atomistique)
L'énergie d'un niveau est donnée par
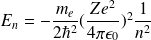 avec
avec
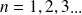 où
où
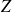 ,
,
 et
et
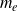 désignent respectivement le nombre de charge atomique, la charge élémentaire et la masse de l'électron.
désignent respectivement le nombre de charge atomique, la charge élémentaire et la masse de l'électron.
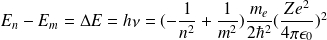
soit encore:
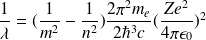
Pour l'atome d'hydrogène (
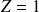 ) on obtient :
) on obtient :
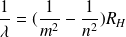
avec la constante de Rydberg :
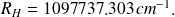
Bien que dépassé aujourd'hui, le modèle de Bohr a permis de retrouver - qualitativement - les mesures expérimentales, et ouvert la voie à une meilleure description de la structure atomique.





